
Elektrolyty, leptací roztoky, kovy, makromolekulární látky
Princip elekrolýzy
Jsou to roztoky nebo taveniny, které vedou elektrický proud. V tomto případě proud přenášejí elektricky nabité částice zvané ionty. Jejich pohybem dochází k přenosu hmotny a chemickým změnám. Podstata jejich vodivosti je jiná než u kovů. Kovové vodiče se průchodem elektrického proudu nemění a nazývají se vodiče první třídy. Elektrolity se průchodem elektrického proudu rozkládají a nazývají se vodiče druhé třídy. Mezy elektrolyty řadíme kyseliny, zásady a soli.
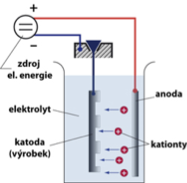
Co se děje při elektrolýze?
- Kladně nabité kationty se pohybují k záporné elektrodě - katodě.
- Na záporné elektrodě kationty přijímají elektrony - redukují se.
- Zaporně nabité anionty se pohybují směrem ke kladné elektrodě.
- Na kladné elektrony anionty odevzdávají elektrony.
Elektrolýza (obecně)
Fyzikálně-chemický jev, způsobený průchodem elektrického proudu kapalinou, při kterém dochází k chemickým změnám na elektrodách. Elekticky vodivá kapalina obsahuje směs kladných a záporných iontů vzniklých v kapalině disociací. Průchodem elektrického proudu dochází k pohybu kladných iontů k záporné elektrodě a záporných iontů ke kladné elektrodě. Na elektrodách pak může docházet k chemickým reakcím - mezi ionty a elektrodou, mezi ionty samotnými nebo mezi ionty a kapalinou (díky vyšší koncetraci iontů u elektrody)...
- Účinkem střídavého proudu probíhá střídavě vylučování a rozpouštění kovu elektrody. Tento elektrochemický děj se využívá při elektrochemické zdrsňování ofsetových tiskových desek. Při průchodu proudu elektrolytem reagují elektrony s částicemi roztoku. Na katodě se s nimi slučují a na anodě se z nich uvolňují. Tak probíhájí elektrochemické reakce.
- Na rozdíl od elektronových vodičů je vedení proudu v elektrolytu provázeno chemickými změnami. Průchod produ elektrolytem a jim vyvolané změny se nazývá elektrolýza. Elektrony vedou elektrický proud hůře než kovy.
- V polygrafii se využívají elektrochemické reakce (tedy chemické změny), které probíhají v elektrolytu na elektrodách při průchodu el. proudu v procesu galvanického pokovování a při elektrochemickžch úpravách povrchu.
- Elektrochemický děj, při kterém se na povrchu elektrody vylučuje kov se nazývá galvanické pokovování, uskutečňuje se účinkem jednosměrného elektrického proudu.
Galvanické pokovování je pokovovací proces (elektrochemický děj), kdy se ionty kovu v roztoku pohybují v elektrickém poli tak, aby vytvářely povlak na elektrodě. Používá se stejnosměrný proud. Kationty dané látky se na katodě redukují z roztoku a potahují vodíkový předmět tenkou vrstvou materiálu. Galvanické pokovování se užívá především pro vytvoření vrstvy s požadovanými vlastnostmi (např. odolnost vůči oděru a obrusu, proti korozi, pro kluzkost, estetické vlastnoti apod.) na povrchu, který tyto vlastnosti postrádá. Metodu lze však použít i pro zvětšení příliš malých předmětů.
Druhy elektrolytů
Niklovací elektrolyty
Nejčastěji se používá elektrolyt, jehož podstatou je CuSO4 nebo síran nikelnatoamonný ve vodě s přídavkem nějakých solí pro zvýšení vodivosti (NaCL, ...)
Chromovací elektrolyt
Nejčastěji se používá elektrolyt obsahující kyselinu chromovou H2CHO4 a přídavek trojmocného chrómu nebo železa. Chromování se používá pro zvýšení životnosti např. hlubotiskových válců.
Mědící elektrolyt
K poměďování lze použít alkalický a kyselí mědící elektrolyt. Kyselý elektrolyt neobsahuje na rozdíl od alkalického. Jedovaté složky, ale zase na druhou stranu koroduje pokovované ocelové předměty, proto se tyto ocelové předměty musí před poměďováním poniklovat.
- elektrochemicky se připravují povrchy kovů, v polygrafii jde především o zdrsňování a anodickou oxidací hliníkových desek pro ofset
- využívá se zde střídavého nebo stejnosměrného proudu
Leptací roztoky
- Z chemického hlediska je leptání kóvů jejich rozpouštění v roztoku leptadla. Jako leptadla se používají kyseliny a jejich soli.
- Existují leptací roztoky na štočky, ofsetové desky (bimetalické a trimetalické) a hlubotiskové válce. Dnes se zhotovují hlubotiskové válce elektrorytecky nebo laserem. Dříve se leptání hlubotiskových válců uskutečňovalo v leptacích strojích. Jako leptadlo se používal roztok chloridu železitého FeCl3.
- Rozpouštění mědi v FeCL3 lze znázornit rovnicemi:
Cu + 2FeCl3 -> 2FeCl2 + CuCl2
Cu + FeCl3 -> FeCl2 + CuCl
Kyseliny
Leptací roztoky
a) kyseliny (ky. chlorovodíková, kys. dusičná, kys. fosforečná, kys. octová, kys. sírová)
Podle míry disociace rozlišujeme
- kyseliny silné - H2SO4, HNO3, HCl, HBr
- kyseliny středně silné - HF, H3PO4, H2SO3, HNO2
- kyseliny slabé - H2S, H3BO3, H2CO3
Kyselina chlorovodíková HCl (též kyselina solná)
- Velmi silná kyselina, jedna z lidstvu nejdéle známých a nejvíce využívaných
- Vodný roztok plynného chlorovodíku (HCl)
- V H2O žlutě zabarvené
- Hustota 1,187 x 103 kg x m3
Kyselina dusičná HNO3
- Významná silná minerální kyselina
- Čistá bezvodá kyselina dusičná (100%) je bezbarvá kapalina
- V H2O se mísí v každém poměru
- Bouřlivě reaguje s kovy
- Hustota 1,5 x 103 kg x m3
Kyselina fosforečná H3PO4 (trihydrogen fosforečná)
- Středně silná kyselina
- Dodává syrupovitý roztok 83-90% kyseliny
- kyselina fosforečná se opoužívá při zpracování ropy a při úpravě kovů. Využívá se při tvorbě nealkoholických nápojů (používý se označení E338, obsahuje ji např. Coca-Cola)
- Hustota 1,88 x 103 kg x m3
Kyselina octová CH3COOH
- bezbarvá kapalina ostrého zápachu
- dokonale mísitelná s vodou, s ethanolem i dimethyletherem
- Za nižších teplot tuhne na krystalickou látku připomínající led
- Hustota 1,49 x 103 kg x m3
Kyselina sírová H2SO4
- Bezbarvá olejovitá kapalina bez zápachu
- V koncentrovaném stavu je hustá olejnatá kapalina
- Je velmi nebezpečnou žiravinou, způsobuje dehydrataci (zuhelnatění) organických látek
- Hustota 1,8 x 103 kg x m3
Zásady / Alkálie
V chemii je protikladem kyseliny. Zásady jsou látky, které mají pH větší než 7 (např. NaOH nebo C(OH)2). Reaguje s kyselinami za vzniku solí (např. HCl + NaOH, NaCl + H2O). Jsou to lázky, které obsahují volné, vazebně nevyužité elektronové páry.
Zásady se v polygrafii vyskytují v podobě tekutých látek.
b) alkálie-zásady (hydroxid draselný, hydroxid sodný)
Hydroxid sodný (NaOH)
- Bílá hydroskopická látka rozpustná ve vodě
- Používá se jako odmasťovací prostředek před elektrochemickými úpravami kovů, jako součást lepidel a vývojek
Hydroxid draselný (KOH)
- Výroba i použití podobná jako NaOH, silně zásaditá sloučenina, dobře rozpustná ve vodě a slabších alkoholech
Amoniak NH3 čpavek
- Při vdechování poškozuje sliznici
- Bezbarvý velmi štiplavý plyn, toxická nebezpečná látka, výroba přámou syntézou N2 + 3H2 + 2HN3
Kovy a slitiny používané v polygrafii
Pod pojmem kovy rozumíme prvky, které mají ve vnější vrstvě elektronového obalu málo valenčních elektronů (1-3). Kovy jsou prvky chemicky charakterizované jako elektropozitivní.
Od nekovů se liší tím, že
- Mají kovový lesk
- Jsou tavné, houževnaté, kujné, tažné
- Mají velkou elektrickou a tepelnou vodivost
- Malou elektronegativitu
Všechny tyto typické vlastnosti jsou dány charakterem jejich struktury. Uspořádáním atomů může vzniknout hexagonální nebo plošné centrovaná krychlová struktura, ve které krystalizuje většina kovů. Menší část krystalizuje v prostorově centrované krychlové struktuře
Rozdělení kovů podle:
- Hustoty - lehké (např. Na, Mg, Al), těžké (Fe, Cu, Pb, Hg)
- Stálosti na vzduchu - ušlechtilé (např. Pt, Au, Ag), neušlechtilé (např. Mg, Fe, Zn)
- Dostupnosti a ceny - drahé (např. Pt, Au, Ag), ostatní (např. Al, Fe, Zn)
Olovo (Pb - Plumbum)
- Nízkotavitelný, měkký, velmi těžký, toxický kov, za teplot pod 7,196 K je supravodičem I. typu
- V přírodě se vyskytuje nejčasti ve formě sulfidu. PbS v minerálo galenitu. Olovo se z něj vyrábí průmyslově oxidací na oxidu a následnou redukcí oxidem uhelnatým (CO2) na kovové olovo
- 3O2 + 2PbS -> 2SO2 + 2PbO
- PbO + CO -> CO2 + Pb
- Teplota tání olova je 372°C
- Hustota 11,34 x 103 kg x m3
- V polygrafii se používá hlavně na slitiny, v elektrochemii k výrobě elektrod (apod)
Hliník (Al - Aliminium)
- Po kyslíku a přemíku 3. nejrozšířenějším prvkem v přírodě
- Výskyt pouze v minerálech bohmitu ALO(OH), kryolit a korund
- Teplota tání 660°C
- Hustota 2,7 x 103 kg x m3
- Kujný, tažný, lze jej vyválcovat na velmi tenké plechy a fólie
- V polygrafii se využívá ve formě plechů a folií a na výrobu tiskových desek
Měď (Cu - Cuprum)
- Nejznámější nerost obsahující měď je chalkopyrit CuFeS2, kuprit Cu2O, chalkozin, Cu2S, malach azurit
- Vyrábí se především ze sulfidových rud pražením a následnou redukcí vzniklého CuO na kov
- Teplota tání 1084°C
- Hustota 8,92 x 103 kg x m3
- V polygrafii se využívá schopnost Cu přijímat mastnou tiskovou barvu a díle dobrá lepivost
- Využití při výrobě válců
Železo (Fe - Fernum)
- V přírodě se vyskytuje vždy ve sloučeninách s jinými prvky. Využívají se zejména rudy krevel, magnazit, limonit, siderit
- V praxi se používá hlavně v pdobě, tedy jako slitiny s uhlíkem a dalšími kovy
- Teplota tání 1535°C
- Hustota 7,86 x 103 kg x m3
- V polygrafii se používá především jako konstrukční materiál a na jádro hlubotiskových valců.
Makromolekulární látky => Polymery
Sem patří pyethylen, polypropylen, polyvinilacetát (lepidla), polyvinilalkohol, polyvinil chlorid
Polymerace: chemická reakce, při které z malých molekul monomerů vznikají vysokomolekulární látky polymery
Polyethylen (PE)

- termoplast, který vznika polymerací ethenu CH2=CH2
- odolný vůči kyselinám i zásadám př. vodě, hydroxidům, mrazu, použitelný do teploty kolem 80°C
- PE je v současnosti nejpoužívanějším polymerem na světě
- Použití: sáčky (mirkoten), cedníky, nádoby, hadice, hračky, instalační zařízení, smrštitelné fólie
Polypropylen (PP)

- -CH2-CH-CH3
- termoplastický polymer
- patří mezi nejběžnější plasty
- křehne při nízkých teplotách, kolem 140-150°C měkne, kolem 160-170°C se taví
- je odolný vůči olejům, organickým rozpouštědlům a alkoholům, dobře se rozpoští v xylenech či tetrahydronaftalenu. Propylen vyniká velmi dobrou chemickou a mechanickou odolností
- je často používán pro výrobu lan a provazů kvůli své nízké hustotě hmotnosti - lana jsou pakd ostatečně lehká, takže můžou plavat na hladině
- také se užívá jako alternativa k PVC pro izolaci elektrických kabelů v málo větraných prostředích, především v tunelech.
Polyvinylchlorid (PVC)-CH2-CH-CL
- termoplastický polymer
- druhou nejpoužívanější umělou hmotnou na Zemi
- těkavý, jemně nasládlý plyn, bod varu 139°C
- od většiny běžných okastl se liší obsahem chrlóru
- značná chemická odolnost, dobrá tepelná odolnost
- odolává působení kyslíku a ozónu. Při korozivních účincích jsou důležitými faktory teplota, koncentrace činidla a čas působení
- je stálý vůči působení většiny zředěných i koncetrovanýchkyselin a louhů, minerálních olejů, alkoholů a vody
- dnes nahrazuje tradiční stavební materiály jako dřevo, beton či hlínu a textilní materiály
- měkčený PVC je široce využíván při produkci fólii, které se následně využívají v obalové technice, v obuvnickém, oděvním a čalounickém průmyslu. Je polotovarem při výrobě hadic, průžných trubek, dětských hraček a výrobků pro domácnost, často v kombinaci s vhodnou tkaninou - ubrusy, podlahové krytiny, obkladačky apod.
Polyvinylchlorid (PVC)-CH2-CH-CL
- Průhledný syntetický polymer s vlastnosti termoplastu
- Běžně známý jako plexisklo nebo akrylátové sklo
- Slouží pro výrobu tzv. organického skla a různých výrobků pro domácí a technickou potřebu
- Při zasklívání oken dopravních prostředků, při výrobě krytů přístrojů, kancelářských potřeb, hodinkových sklíček apod. Významné jsou aplikace PMMA v zubní protéze.
- Blokovou polymeraci se připravují také tzv. optické, měkké kontaktní čočky
- PMMA se používá v mnoha případech jako náhražka skla, jinou alternativou je polykarbonát. Výhodou PMA v porovnání se sklem jsou nízké výrobní náklady, snadná možnost ohýbání, nižší hmotnost a větší odolnost vůči nárazům. Nevýhodoou je naopak nižší chemická odolnost i tvrdost v jejimž důsledku dochází k jeho poškrábaní
- Zpracování PMMA se provádí obvykle při teplotách 240 - 250°C. Lze používat všechny běžné technologie tvarování plastů jako např. vstřikování, lisování a tažení. K nejběžnějším polotovarům patří desky a tyče
Polysacharid (C6H10O5)n
Používá se při výrobě papíru, obsažen v celulóze.
Celulóza - hlavní složka dřeva, obsažena v buničných stěnách, polysacharid (C6H1005)n